ĐỀ CƯƠNG THAM KHẢO ÔN THI HÓA 8 HỌC KỲ 2
ÔN TẬP HỌC KỲ II HÓA 8 NĂM HỌC 2022 – 2023 -TỔNG HỢP Ý CÂU HAY

Câu 1. Trình bày: tính chất vật lý, hóa tính, điều chế trong phòng thí nghiệm, trong công nghiệp và ứng dụng của Hydrogen.
Câu 2.
a) Định nghĩa: chất khử, phản ứng thế. Lấy 2 ví dụ cho mỗi trường hợp.
b) Tính chất vật lý, tính chất hóa học, vai trò của nước trong đời sống.
Câu 3. Có các khí sau: SO2, O2, N2, CO2, CH4.
a) Những khí trên nặng hay nhẹ hơn khí hydrogen bao nhiêu lần?
b) Những khí trên nặng hay nhẹ hơn không khí bao nhiêu lần?
Câu 4. Cho các oxide: CO2, SO2, P2O5, Al2O3, Fe3O4, Na2O, BaO, N2O5, MgO, K2O, ZnO, SiO2, CaO, SO3, CuO, FeO.
a) Có bao nhiêu oxide tác dụng với nước tạo ra base tương ứng? Viết phương trình phản ứng và gọi tên sản phẩm.
b) Có bao nhiêu oxide tác dụng với nước tạo ra acid tương ứng? Viết phương trình phản ứng và gọi tên sản phẩm.
Câu 5. Lập công thức base ứng với các basic oxide sau:
| Basic oxide | Base |
| CuO: copper (II) oxide | Cu(OH)2: copper (II) hydroxide |
| FeO | |
| Fe2O3 | |
| Na2O | |
| MgO | |
| BaO | |
| CaO | |
| Al2O3 |

Câu 6. Lập công thức acid ứng với các acidic oxide sau:
| Acidic oxide | Acid |
| CO2: carbon dioxide | H2CO3: carbonic acid |
| SO2 | |
| P2O5 | |
| SO3 | |
| N2O5 |
Câu 7. Hoàn thành bảng sau:
| CTHH | Tên gọi | Phân loại |
| CO2 | ||
| Hydrochloric acid | ||
| Potassium hydroxie | ||
| Na2CO3 | ||
| H2SO4 | ||
| Ca(OH)2 | ||
| NaNO3 | ||
| P2O5 | ||
| Calcium carbonate | ||
| Nitric acid | ||
| Fe3O4 | ||
| KOH |
Câu 8. Bằng phương pháp hóa học hãy nhận biết:
a) 3 dung dịch: KNO3, H2SO4, Ba(OH)2.
b) 3 dung dịch: KOH, Ca(NO3)2, HCl.
c) dung dịch HCl, dung dịch NaOH và Ba(NO3)2.
d) Ba lọ chứa ba chất khí: CO2, O2, H2.
e) 4 bình đựng riêng biệt các khí sau: không khí, khí oxygen, khí hydrogen, carbon dioxide (CO2).
f) 3 gói bột mất nhãn chứa các chất sau: Na2O, SO3, MgO.
Câu 9. Aluminum oxide (Al2O3) tác dụng với sulfuric acid (H2SO4) theo phương trình hóa học sau:
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
a) Cân bằng phản ứng hóa học trên.
b) Tính khối lượng muối aluminum sulfate: Al2(SO4)3 tạo thành khi có 49 gam H2SO4 tham gia phản ứng.
Câu 10. Hòa tan hoàn toàn 5,6 gam iron (Fe) tác dụng với hydrocholric acid (HCl).
a) Viết phương trình hóa học và cân bằng phản ứng.
b) Tính khối lượng muối iron (II) chloride (FeCl2) thu được và thể tích khí hydrogen (H2) sinh ra ở đkc.
Câu 11. Trong phòng thí nghiệm có zinc (Zn) và Iron (Fe), dung dịch sulfuric acid (H2SO4) loãng.
a) Viết các phương trình phản ứng điều chế khí hydrogen (H2) từ hai kim loại và acid trên.
b) Phải dùng bao nhiêu gam zinc (Zn) và bao nhiêu gam Iron (Fe) để điều chế 2,479 lít khí H2 (đkc).
Câu 12. Trong phòng thí nghiệm người ta dùng khí CO để khử 0,3 mol Fe3O4 và dùng khí H2 để khử 0,4 mol Fe2O3 ở nhiệt độ cao.
a) Viết các phương trình hóa học của phản ứng trên.
b) Tính thể tích khí CO và khí H2 dùng cho mỗi phản ứng trên ở đkc.
c) Tính khối lượng Fe thu được ở mỗi phản ứng trên.
Câu 13. Khử 21,7 gam mercury (II) oxide (HgO) bằng khí hydrogen (H2).
a) Tính số gam Hg thu được.
b) Tính thể tích H2 (đkc) tham gia phản ứng.
Câu 14. Bổ túc và cân bằng các phản ứng sau:
| a) Na + H2O → ? + ? | b) ? + H2 → Cu + H2O |
| c) Ba + H2O → ? + ? | d) ? + H2 → H2O |
| e) Na2O + H2O → ? | f) ? + H2 → Fe + H2O |
| g) BaO + H2O → ? | h) SO3 + H2O → ? |
| i) CaO + H2O → ? | j) CO2 + H2O → ? |
| k) P2O5 +H2O → ? | l) N2O5 + H2O → ? |
| m) Ca + H2O → ? + ? | n) SO2 + H2O → ? |
Câu 15. Cho 5,4 g aluminium (Al) tác dụng với dung dịch có chứa 39,2 g sulfuric acid.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Thể tích khí hydrogen (H2) thu được ở đkc.
Câu 16. Cho các dung dịch sau: NaOH, Ca(OH)2, HNO3, H2SO4, HCl, KOH. Có bao nhiêu dung dịch làm quỳ tím hóa đỏ, làm quỳ tím hóa xanh?
Câu 17. Cho 13,7 gam barium (Ba) tác dụng hết với nước.
- a) Viết phương trình hóa học xảy ra.
- b) Tính khối lượng barium hydroxide, và thể tích khí H2 thu được ở đkc.
Câu 18. Để thu được 12,8 gam copper (Cu) cần lấy bao nhiêu gam Copper (II) oxide (CuO) và bao nhiêu thể tích khí hydrogen (H2) ở đkc để khử CuO?
Câu 19. Tính lượng sodium hydroxide (NaOH) thu được khi cho những lượng sodium (Na) sau tác dụng với nước:
a) 46 gam Na. b) 0,3 mol Na.
Câu 20. Viết phương trình hóa học biểu diễn những chuyển hóa sau:
| a) Ca → CaO → Ca(OH)2 | b) Na → NaOH |
| c) Ca → Ca(OH)2 | d) S → SO2 → H2SO3 |
| e) Na → Na2O → NaOH | f) Cu → CuO → Cu |
Câu 21. Cho 6,5 gam zinc (Zn) vào dung dịch chứa 0,25 mol hydrochloric acid (HCl).
- a) Tính thể tích khí hydrogen (H2) thu được ở đkc.
- b) Sau phản ứng chất nào còn dư? Khối lượng bao nhiêu?
- c) Cần bao nhiêu gam chất còn lại để tác dụng hết với lượng chất dư.
Câu 22. Cho 22,4 gam iron (Fe) tác dụng với dung dịch loãng chứa 24,5 gam sulfuric acid (H2SO4).
a) Tính thể tích khí hydrogen (H2) thu được ở đkc.
b) Sau phản ứng chất nào còn dư? Khối lượng bao nhiêu?
c) Cho toàn bộ khí H2 phản ứng trên tác dụng hết với CuO đun nóng. Hãy tính khối lượng nước tạo thành.
Câu 23. Nêu hiện tượng và giải thích khi:
a) Cho sodium (nhỏ bằng hạt đậu xanh) vào chậu thủy tinh đựng nước. Sau đó cho giấy quỳ tím vào dung dịch thu được.
b) Cho diphosphorus pentoxide vào chậu thủy tinh đựng nước. Sau đó cho giấy quỳ tím vào dung dịch thu được.
c) Cho barium oxide vào chậu thủy tinh đựng nước. Sau đó cho giấy quỳ tím vào dung dịch thu được.
d) Dẫn khí hydrogen dư qua bột copper (II) oxide đun nóng.
Câu 24. Dẫn 2,479 lít khí hydrogen (đkc) qua chén sứ đựng 32 gam oxide đun nóng.
a) Cho biết chất nào phản ứng hết chất nào dư?
b) Tính khối lượng chất rắn thu được sau phản ứng.
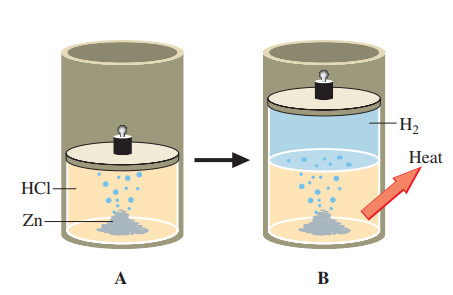
Câu 25. Cho 3,25 gam Zinc (Zn) tác dụng hết với dung dịch hydrochloric acid (HCl) tạo ra Zinc chloride (ZnCl2) và khí hydrogen.
a) Viết phương trình hóa học của phản ứng?
b) Tính thể tích dung dịch hydrochloric acid (HCl) 0.5M đã phản ứng?
c) Cho một hỗn hợp gồm Alunimium (Al) và Iron (Fe) tác dụng hết với dung dịch H2SO4 thấy thoát ra khí hydrogen đúng bằng lượng hydrogen thu được ở phản ứng trên. Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp, biết số mol của hai kim loại này trong hỗn hợp bằng nhau?
https://giasunguyendu.com/de-tham-khao-on-thi-hoa-8-hoc-ky-2/